|
|
年末の20,21日の2日間,首都圏の放射線技師を中心に標記セミナーが持たれた。講師は,初日の「薬事法」に富士フイルムメディカル・岩田貴氏,2日目の「医療制度改革」には日本画像医療システム工業会(JIRA)の法規・経済部会経済委員会委員長を務める同社の野口雄司氏があたった。以下,両氏の講義をサマライズする。 |
|
|
(文責編集部)
|

岩田氏 |
|
薬事法改正について
薬事法は,「医薬品,医薬部外品,化粧品及び医療用具の品質,有効性及び安全性の確保のために必要な規制を行うとともに,医療上特にその必要性が高い医療品及び医療用具の研究開発の促進のために必要な措置を講ずることにより,保健衛生の向上を図ることを目的」(同法第1条)として,主に企業が行う製造・販売を規制する法律である。したがって,医療従事者にはあまり関係がないように思われがちだが,数次にわたる改正を経て不具合報告制度や添付文書の規程など非常に関係のある内容が盛り込まれてきている。
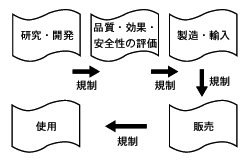
その規制は,下図に示すように製品の研究・開発から使用に至る一連の過程のそれぞれの局面でなされている。具体的には,研究・開発の段階では臨床試験の届出制度,希少疾病用医薬品の開発促進制度があり,品質・効果・安全性の評価のフェーズでは製造・輸入承認許可制度がある。次の製造・輸入では製造/品質管理に関する規制,ラベル/添付文書の表示に関する規制,各種の公的品質基準,国家検定制度が,販売では薬局,販売業許可制度,取り扱いに関する規制(毒薬・劇毒など),薬事監視員制度,不良医薬品に関する規制,広告に関する規制が取り入れられている。そして使用のフェーズでは,副作用報告義務制度,再審査制度,再評価制度,などがある。研究・開発から使用に至る各段階に種々の規制や基準,手続きを設けることによって,品質・有効性・安全性を確保しているのである。 |
|
|
 |
|
|
薬事法の歴史的変遷は,明治維新政府による明治元年の西洋医学の採用宣言,明治7年の後の医師法・薬剤師法などの基本骨格となる「医政」の公布などを淵源とし,表のようごく簡略にまとめられる。そして昭和35年に制定された薬事法が今日に至っているものであり,各時代の医学・薬学の進歩,社会発展に伴って改正され,充実が図られてきた。今後も,高齢化社会の進展,科学のめまぐるしい進歩によって,さらなる変遷が予想される。 |
|
|
| 明治 7 年(1874) |
医制 |
| 明治13年(1880) |
薬品取締規則 |
| 明治22年(1889) |
薬品営業並薬品取扱規則 |
| 昭和18年(1943) |
旧々薬事法 |
| 昭和23年(1948) |
旧薬事法 |
| 昭和35年(1960) |
薬事法 |
| 昭和54,58,平成6,8年など 薬事法改正 |
|
|
|
こうしたなか,平成6年の改正では医療機器の特質に応じた安全性確保,8年のそれでは医薬品の治験から承認審査および市販後までに至る安全性確保が図られ,今回14年の改正(14年7月31日公布,15年から17年にかけて段階的に施行)では「21世紀=ライフサイエンスの世紀」のニーズに合わせた薬事制度の見直し,バイオ・ゲノムの技術の進展と応用,産業活動などのグローバル化と国際的な整合性が図られた。新たな医療機関の取り組みとしては,(1)医療関係者による,生物由来製品の安全性確保,(2)医療機関が,医薬品の副作用,医療機器の不具合やこれらによる感染症などについて厚生労働省に報告,(3)医療機関が主体となって実施する治験,があげられる。
薬事法で放射線部門にかかわりの深いのは,第77条の3に規定された「情報の提供等」についてである。その3の1では「企業等の情報提供義務」が記され,3の2では「医療関係者に対しての企業等の情報収集などに協力すること」,3の3では「医療関係者は企業からの情報を十分に活用し,また自ら医薬品等に関する情報を収集・検討・利用すること」が記されている。医療関係者を対象とし「医療のありよう」に触れた,薬事法に「医療法規」としての性格が付加されているのである。また平成15年7月30日から,医療機関等は,医薬品または医療用具について副作用などの発生を知った場合,必要があると認めるときは,厚生労働大臣に対して直接に報告することが義務づけられた。
では,どういうことを報告するのかをみると,(1)医療用具は健康被害が発生するおそれのある不具合も含める,(2)医療用具との因果関係が必ずしも明確でない場合であっても報告の対象となる,(3)添付文書等から予測できない未知の症例等の発生なども対象となるとして,安全性情報報告制度の強化が徹底されている。ここで,「添付文書」とは薬事法第63条の2に基づき,医薬品・医療用具等に関する安全を確保するための情報提供用に取扱説明書とは別に当該機器に添付するとされたもので,すべての医療機器を販売する場合は,当該機器の適正使用に際して「必要」な安全上の注意事項を記載した添付文書をつけることが要求されている。薬事法上は取扱説明書より上位に位置づけられ,製品によっては取扱説明書の代わりに添付文書のみとなる場合もあり,すべての医療用具を対象に平成15年1月14日から完全施行された。
こうして提出された不具合報告は,1社の製品だけにかぎらず,同じ製品をつくっている業界全体として再考するよう求めるもので,次の新しいものをつくっていくための指針にしていきたいという意向も厚労省にはあるようだ。放射線部門では,医療安全のためにまず,添付文書の集中管理,添付文書による職員教育,記録保存,不具合報告,年1回以上の定期点検,始業・終業時の点検,使用状況記録,異常・事故発生時の報告体制などを確立すべきであろう。
この添付文書に関しては,すでに平成8年1月23日,「医師が医薬品を使用するに当たって医薬品の添付文書(能書)に記載された使用上の注意事項に従わず,それによって医療事故が発生した場合には,これに従わなかったことにつき,特段の合理的理由がない限り,当該医師の過失が推定される」との最高裁判決が出されている。
ここで改正薬事法の改正内容をみると,医療機器(改正薬事法では,従来の「医療用具」に代わりこの用語が使われる)のクラス分類が,現行のリスクに応じた分類制度によるクラスI(フィルム,鋼製小物),クラスII(画像診断機器),クラスIII(放射線治療装置),クラスIV(ペースメーカー)の分類から,GHTF(医療機器規制国際整合化会議)でまとめられつつあるクラス分類案にそって,一般医療機器(クラスI該当機器:フィルム・自動現像機,レーザーイメージャーなど),管理医療機器(クラスII該当機器:X線撮影装置・CR,フラットパネル・CT・MRIなど),高度管理医療機器(クラスIII,IV該当機器:人工呼吸器・ペースメーカー・カテーテルなど)に変更される。
さらに,クラス分類に関係なく,保守点検,修理その他の管理に専門的な知識および技能を必要とすることから,その適正な管理が行われなければ疾病の診断,治療または予防に重大な影響を与えるおそれがあるものとして,特定保守管理医療機器の指定がなされ,画像診断分野は95%以上この指定に入る。そして,特定保守管理医療機器のなかでさらに設置が必要な機器は,製造販売業者が交付する設置管理基準書に基づき,適正な方法により設置にかかる管理を行わなければならない設置管理医療機器の指定がなされる。補足説明すると,納入設置時の仕様および医療機器の品質,有効性および安全性を確保するために販売業者または賃貸業者が納入または賃貸時の設置に,専門的な知識および技能を必要とし,その適正な管理を行わなければならない医療機器で,添付文書等に設置管理医療機器と指定されるもので,当該医療機器の移設,または修理等で修理業者が当該医療機器の設置に専門的な知識および技能を必要とし,その適正な管理を行わなければならない医療機器である。
また,市販後体制・品質確保体制の全責任を負う「製造販売業」を新設するなど,業の役割が明確化された。製造販売業は市販後の全責任,販売業は販売・設置責任,修理業は修理作業責任を負うことになる。そして,特定保守管理医療機器については,医療機器のクラス分類が販売規制のない一般医療機器,販売業届出の管理医療機器であっても,特定保守管理医療機器に指定されると,販売業は許可が,修理業は特定修理業許可が必要とされる。特定保守管理医療機器の販売・修理時には,互いの販売業許可・特定修理業許可取得の確認を励行されたい。
厚労省の医療機器産業ビジョンでも,安全に対する取り組みが示されており,医療機関ごとにおける保守管理を徹底するとともに,保守管理検査制度を導入し,医療機関における医療機器の保守管理状況に関する一定期間ごとの第三者による点検義務化や,モデル病院の設置などにより,医療機関における医療機器の評価・選定・保守管理・廃棄までの一貫した窓口としてのME部(薬剤部と同様な機能を想定)の設置などの検討がなされている。また,企業に対しては医療機器版MR資格(民間資格)の創設の検討もなされているようだ。医学・工学に関する専門知識を備えた医療機器MR資格を設けることにより,特に安全への配慮が求められる分野における情報提供を充実するとともに,臨床現場のニーズを製品開発に還元することによる革新的医療機器開発を促進するものである。「医療安全」をキーワードに種々の改革・実践が行われつつあることがうかがわれる。
|

野口氏 |
|
診療報酬改定の行方
本セミナー開催直前の12月18日,厚生労働大臣の諮問機関である中央社会保険医療協議会(中医協)において,平成16年度4月実施の診療報酬改定率を,本体部分はゼロ改定,薬価と医療材料をマイナス1.05%,全体として1.05%引き下げることで決着,政府・与党も合意した―翌日付新聞等でそう報じられたこともあり,2日目の「医療制度改革」の講義は診療報酬改定の話題が中心になった。
本体部分ゼロ改定に至るプロセスとしては,当初保険側(支払い側)が(1)人事院勧告,物価指数などによる成長力マイナス3.7%,(2)小児医療等への配慮などを総合的に判断してマイナス2.7%の改定率を主張したのに対し,医療提供側(診療側)は医療安全と質の向上を名目に医療費の4.2%に相当する1兆2500億円のアップ要求していたものが,保険側マイナス0.5%,医療提供側0.5%引き上げへと歩み寄りを見せ,結局マスコミ報道のようなかたちとなったようである。具体的診療項目の検討は1月から,メリハリをつけた体系を目指して行われるとのことで,ぜひ注目していきたいものである。ゼロ改定の結果,構造改革の名のもとにドラスティックな人員削減が行われることも予測されるので,特に配置基準が決められていないコ・メディカルにとっては予断を許さない状況であろう。
こうしたなかJIRAでは,画像診断領域における診療報酬改定に関する業界サイドの重要課題として,(1)CT・MRにおける撮影料の積算根拠の明確化,(2)保守維持管理諸経費の明文化,(3)「画像モニタ診断」に不公平感のない評価,(4)遠隔画像診断における送信側・受信側の適用施設の拡大,(5)マンモグラフィ診断・撮影の別体系化,の5つをあげている。中医協における議論は,基本的には保険者側と医療提供者側の綱引きで,後者の中心は日本医師会である。JIRAとしてはこれまで各種要望書を行政などに送ってきたが,それだけでは打開できないので,今後,日医,関係の学会,日本放射線技師会などの各種団体にも送付,情報の共有化を図りつつ進めていきたいとした。
|
|
|
本セミナー(THE PROGRESS SEMINAR)についての問い合わせは,社会保険新宿健診センター 吉田浩子,suiren@aaw.alliednet.ne.jp宛へ。 |
|
|
(編集部) |